Archive for April 2018
Analisis Pembentukan Struktur Sekunder dan Tersier Pada Protein
- Protein adalah makromolekul yang paling banyak ditemukan di dalam sel makhluk hidup dan merupakan 50 persen atau lebih dari berat kering sel. Protein memiliki jumlah yang sangat bervariasi yang mulai dari struktur maupun fungsinya. Peranan protein diantaranya sebagai katalisator, pendukung, cadangan, sistem imun, alat gerak, sistem transpor, dan respon kimiawi. Protein-protein tersebut merupakan hasil ekspresi dari informasi genetik masing-masing suatu organisme tak terkecuali pada bakteri (Campbell et al., 2009; Lehninger et al., 2004). Protein dan gen memiliki hubungan yang sangat dekat dimana kode genetik berupa DNA dienkripsi dalam bentuk kromosom yang selanjutnya kode genetik tersebut ditranslasikan menjadi protein melalui serangkain mekanisme yang melibatkan RNA dan ribosom (Vo-Dinh, 2005).PENYUSUN PROTEINProtein tersusun dari peptida-peptida sehingga membentuk suatu polimer yang disebut polipeptida. Setiap monomernya tersusun atas suatu asam amino. Asam amino adalah molekul organik yang memiliki gugus karboksil dan gugus amino yang mana pada bagian pusat asam amino terdapat suatu atom karbon asimetrik (Gambar 1). Pada keempat pasangannya yang berbeda itu adalah gugus amino, gugus karboksil, atom hidrogen, dan berbagai gugus yang disimbolkan dengan huruf R. Gugus R disebut juga sebagai Rantai samping yang berbeda dengan gugus amino. (Campbell et al., 2009).
 Gambar 1. Struktur umum asam amino (Lehninger et al., 2004).
Gambar 1. Struktur umum asam amino (Lehninger et al., 2004). Gambar 2. Level dari struktur protein (Berg et al., 2006).
Gambar 2. Level dari struktur protein (Berg et al., 2006).
STRUKTUR PROTEIN
Protein yang tersusun dari rantai asam amino akan memiliki berbagai macam struktur yang khas pada masing-masing protein. Karena protein disusun oleh asam amino yang berbeda secara kimiawinya, maka suatu protein akan terangkai melalui ikatan peptida dan bahkan terkadang dihubungkan oleh ikatan sulfida. Selanjutnya protein bisa mengalami pelipatan-pelipatan membentuk struktur yang bermacam-macam. Adapun struktur protein meliputi struktur primer, struktur sekunder, struktur tersier, dan struktur kuartener (Gambar 2).Gambar 3. Reaksi pembentukan peptida melalui reaksi dehidrasi (Voet & Judith, 2009).Gambar 4. Struktur primer dari protein (Campbell et al., 2009).Struktur primer merupakan struktur yang sederhana dengan urutan-urutan asam amino yang tersusun secara linear yang mirip seperti tatanan huruf dalam sebuah kata dan tidak terjadi percabangan rantai (Gambar 4). Struktur primer terbentuk melalui ikatan antara gugus α–amino dengan gugus α–karboksil (Gambar 3). Ikatan tersebut dinamakan ikatan peptida atau ikatan amida (Berg et al., 2006; Lodish et al., 2003). Struktur ini dapat menentukan urutan suatu asam amino dari suatu polipeptida (Voet & Judith, 2009).Struktur sekunder merupakan kombinasi antara struktur primer yang linear distabilkan oleh ikatan hidrogen antara gugus =CO dan =NH di sepanjang tulang belakang polipeptida. Salah satu contoh struktur sekunder adalah α-heliks dan β-pleated (Gambar 5 dan 6). Struktur ini memiliki segmen-segmen dalam polipeptida yang terlilit atau terlipat secara berulang. (Campbell et al., 2009; Conn, 2008). Gambar 5. Struktur sekunder α-heliks dan β-pleated (Murray et al, 2009).Struktur α-heliks terbentuk antara masing-masing atom oksigen karbonil pada suatu ikatan peptida dengan hidrogen yang melekat ke gugus amida pada suatu ikatan peptida empat residu asam amino di sepanjang rantai polipeptida (Murray et al, 2009).Pada struktur sekunder β-pleated terbentuk melalui ikatan hidrogen antara daerah linear rantai polipeptida. β-pleated ditemukan dua macam bentuk, yakni antipararel dan pararel (Gambar 7 dan 8). Keduanya berbeda dalam hal pola ikatan hidrogennya. Pada bentuk konformasi antipararel memiliki konformasi ikatan sebesar 7 Å, sementara konformasi pada bentuk pararel lebih pendek yaitu 6,5 Å (Lehninger et al, 2004). Jika ikatan hidrogen ini dapat terbentuk antara dua rantai polipeptida yang terpisah atau antara dua daerah pada sebuah rantai tunggal yang melipat sendiri yang melibatkan empat struktur asam amino, maka dikenal dengan istilah β turn yang ditunjukkan dalam Gambar 9 (Murray et al, 2009).
Gambar 5. Struktur sekunder α-heliks dan β-pleated (Murray et al, 2009).Struktur α-heliks terbentuk antara masing-masing atom oksigen karbonil pada suatu ikatan peptida dengan hidrogen yang melekat ke gugus amida pada suatu ikatan peptida empat residu asam amino di sepanjang rantai polipeptida (Murray et al, 2009).Pada struktur sekunder β-pleated terbentuk melalui ikatan hidrogen antara daerah linear rantai polipeptida. β-pleated ditemukan dua macam bentuk, yakni antipararel dan pararel (Gambar 7 dan 8). Keduanya berbeda dalam hal pola ikatan hidrogennya. Pada bentuk konformasi antipararel memiliki konformasi ikatan sebesar 7 Å, sementara konformasi pada bentuk pararel lebih pendek yaitu 6,5 Å (Lehninger et al, 2004). Jika ikatan hidrogen ini dapat terbentuk antara dua rantai polipeptida yang terpisah atau antara dua daerah pada sebuah rantai tunggal yang melipat sendiri yang melibatkan empat struktur asam amino, maka dikenal dengan istilah β turn yang ditunjukkan dalam Gambar 9 (Murray et al, 2009).
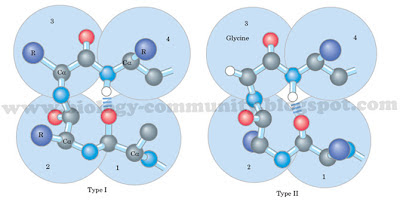
Gambar 7. Bentuk konformasi antipararel (Berg, 2006).Gambar 6. Bentuk konformasi pararel (Berg, 2006).Gambar 7. Bentuk konformasi β turn yang melibatkan empat residu asam amino (Lehninger et al., 2004).Struktur tersier dari suatu protein adalah lapisan yang tumpang tindih di atas pola struktur sekunder yang terdiri atas pemutarbalikan tak beraturan dari ikatan antara rantai samping (gugus R) berbagai asam amino (Gambar 10). Struktur ini merupakan konformasi tiga dimensi yang mengacu pada hubungan spasial antar struktur sekunder. Struktur ini distabilkan oleh empat macam ikatan, yakni ikatan hidrogen, ikatan ionik, ikatan kovalen, dan ikatan hidrofobik. Dalam struktur ini, ikatan hidrofobik sangat penting bagi protein. Asam amino yang memiliki sifat hidrofobik akan berikatan di bagian dalam protein globuler yang tidak berikatan dengan air, sementara asam amino yang bersifat hodrofilik secara umum akan berada di sisi permukaan luar yang berikatan dengan air di sekelilingnya (Murray et al, 2009; Lehninger et al, 2004).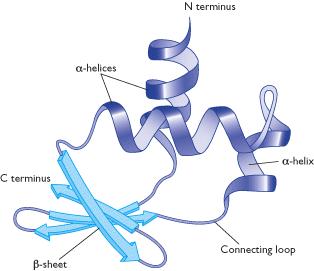 Gambar 8. Bentuk struktur tersier dari protein denitrificans cytochrome C550 pada bakteri Paracoccus denitrificans(Timkovich and Dickerson, 1976).Struktur kuarterner adalah gambaran dari pengaturan sub-unit atau promoter protein dalam ruang. Struktur ini memiliki dua atau lebih dari sub-unit protein dengan struktur tersier yang akan membentuk protein kompleks yang fungsional. ikatan yang berperan dalam struktur ini adalah ikatan nonkovalen, yakni interaksi elektrostatis, hidrogen, dan hidrofobik. Protein dengan struktur kuarterner sering disebut juga dengan protein multimerik. Jika protein yang tersusun dari dua sub-unit disebut dengan protein dimerik dan jika tersusun dari empat sub-unit disebut dengan protein tetramerik (Gambar 11) (Lodish et al., 2003; Murray et al, 2009).Gambar 9. Beberapa contoh bentuk struktur kuartener.
Gambar 8. Bentuk struktur tersier dari protein denitrificans cytochrome C550 pada bakteri Paracoccus denitrificans(Timkovich and Dickerson, 1976).Struktur kuarterner adalah gambaran dari pengaturan sub-unit atau promoter protein dalam ruang. Struktur ini memiliki dua atau lebih dari sub-unit protein dengan struktur tersier yang akan membentuk protein kompleks yang fungsional. ikatan yang berperan dalam struktur ini adalah ikatan nonkovalen, yakni interaksi elektrostatis, hidrogen, dan hidrofobik. Protein dengan struktur kuarterner sering disebut juga dengan protein multimerik. Jika protein yang tersusun dari dua sub-unit disebut dengan protein dimerik dan jika tersusun dari empat sub-unit disebut dengan protein tetramerik (Gambar 11) (Lodish et al., 2003; Murray et al, 2009).Gambar 9. Beberapa contoh bentuk struktur kuartener.
Permasalahan :1.Bagaimana perbedaan antara protein yang tersusun atas ikatan peptida dengan protein yang tersusun oleh ikatan sulfida ?
2.Dengan reaksi apa saja dapat dibentuk ikatan peptida ? jelaskan beserta contohnya
3.Mengapa pada protein struktur sekunder dapat distabilkan oleh ikatan hidrogen antara gugus =CO dan =NH ? - 3 Comments
- Readmore . . .
- Add Comment
Reaksi-Reaksi Spesifik Pada Nukleotida
- Nukleotida adalah molekul yang tersusun dari gugus basa heterosiklik, gula, dan satu atau lebih gugus fosfat. Basa penyusun nukleotida biasanya adalah berupa purina atau pirimidina sementara gulanya adalah pentosa (ribosa), baik berupa deoksiribosa maupun ribosa. Nukleotida adalah monomer penyusun RNA, DNA, dan beberapa kofaktor, seperti CoA, FAD, FMN, NAD, dan NADP. Dalam sel, kofaktor ini memainkan peran penting dalam fiksasi energi (misalnya fotosintesis), metabolisme, dan transduksi sinyal seluler.
Nukleotida yang merupakan monomer asam nukleat (building block) memiliki banyak fungsi dalam metabolisme selular. Sebagai konstituen asam nukleat, deoxyribonucleic acid (DNA) dan ribonucleic acid (RNA), nukleotida berfungsi sebagai gudang informasi genetik. Struktur protein dan metabolisme biomolekul dan komponen selular lainnya merupakan produk informasi yang sudah terprogram dalam nukleotida. RNA juga terdiri atas nukleotida yang memiliki banyak fungsi. Ribosomal RNA (rRNA) adalah komponen ribosom yang bertanggungjawab pada sintesis protein. Massenger RNA (mRNA) merupakan intermediet yang membawa informasi genetik dari suatu gen ke ribosom. Transfer RNA (tRNA) adalah molekul yang menerjemahkan informasi pada mRNA untuk menentukan asam amino spesifik. Selain gudang genetik, nukleotida juga merupakan bagian dari koenzim, donor gugus fosforil (ATP dan GTP), donor gula (UDP dan GDP-gula) atau donor lipid (CDP-asilgliserol). Bentuk energi pada metabolisme tubuh tergantung pada adanya transfer gugus fosforil.Nukleotida memiliki tiga karakteristik komponen yaitu basa nitrogen heterosiklik, gula pentosa dan gugus fosfat. Molekul nukleotida yang gugus fosfatnya mengalami hidrolisis dinamakan dengan nukleosida. Basa dan gula pentosa penyusun nukleotida merupakan bentuk senyawa heterosiklik. Struktur nukleotida dan nukleosida dapat dilihat pada gambar di bawah ini.Basa nitrogen heterosiklik yang menyusun nukleotida yaitu purin dan pirimidin. Ada empat basa nitrogen yang merupakan unit pembentuk DNA yaitu adenin (A), guanin (G), sitosin (C) dan timin (T). Sedangkan pembentuk RNA yaitu adenin (A), guanin (G), sitosin (C) dan urasil (U). Adenin dan guanin merupakan basa nitrogen jenis purin sedangkan sitosin, timin dan urasil adalah derivat pirimidin.Gula pentosa penyusun nukleotida memiliki bentuk furanosa. Dalam nukleotida penomoran atom karbon pada gula pentosa menggunakan tanda prime (‘). Gula pentosa penyusun asam nukleat yaitu 2-deoxy-D-ribosa dan D-ribosa. Basa nitrogen heterosiklik terikat secara kovalen dengan pentosa dalam ikatan N-β-glikosil. Ikatan N-β-glikosil terjadi antara karbon 1’ pada pentosa dengan nitrogen nomor 1 pada pirimidin dan nitrogen nomor 9 pada purin. Gugus fosfat terikat pada karbon 5’ gula pentosa melalui mekanisme esterifikasi sehingga dinamakan ikatan fosfoester.Ribonukleosida dan deoksinukleosida dalam sel tidak hanya berbentuk 5’-monofosfat tetapi juga dapat berbentuk 5’-difosfat dan 5’-trifosfat. Nukleosida 5’-difosfat dan 5’-trifosfat (NDP dan NTP) merupakan asam kuat yang terdisosiasi dengan tiga dan empat proton dari kondensasi gugus fosforik. Oleh karena itu, NDP dan NTP dapat membentuk kompleks divalen dengan Mg2+ dan Ca2+. Dalam sitoplasma, NDP dan NTP ditemukan dalam bentuk kompleks Mg2+. Gugus fosforik dapat mengalami hidrolisis dengan bantuan enzim membentuk molekul fosfat anorganik. ATP adalah salah satu contoh NTP yang memiliki gugus fosfat dan pirofosfat serta berperan pada transfer energi kimia pada reaksi enzimatik. ATP bisa mengalami defosforilasi menjadi ADP, sebaliknya ADP dapat mengalami refosforilasi menjadi ATP pada proses respirasi. Selain sisten ATP-ADP, transfer gugus fosfat pada sel dapat melibatkan GTP, UTP dan CTP. Akan tetapi, sistem GTP, UTP dan CTP hanya berlangsung pada bagian biosintesis spesifik.DNA dan RNAa. Ikatan FosfodiesterMolekul nukleotida akan membentuk asam nukleat dengan membentuk ikatan fosfodiester dimana gugus 5’-fosfat pada unit nukleotida akan berikatan dengan gugus 3’-hidroksil pada unit nukleotida lainnya. Ikatan kovalen pada asam nukleat terdiri atas gugus fosfat dan gula pentosa yang linear dengan basa nitrogen heterosiklik sebagai interval cabangnya. Semua ikatan fosfodiester dapat membentuk rantai panjang yang linear dengan polaritas spesifik pada 5’-end dan 3’-end. Ujung nukleotida yang memiliki posisi 5’ dinamakan 5’-end sedangkan ujung lainnya yang memiliki posisi 3’ dinamakan 3’-end. Berdasarkan konvensi, rantai single asam nukleat selalu digambarkan dengan 5’-end pada kiri dan 3’-end pada kanan sehingga arahnya 5’ -> 3’.
b. DNAOrganisme menterjemahkan informasi spesifik berupa jenis asam amino yang akan menyusun protein dari nukleotida yang menyusun DNA. Kode pada DNA terdiri dari banyak kombinasi 4jenis basa nitrogen pada nukleotida. Informasi yang diterjemahkan dari DNA akan digunakan pada setiap metabolisme pada organisme. Rantai tunggal DNA selalu memiliki gugus 5’ fosfat bebas pada satu ujung dan gugus 3’ hidroksil pada ujung lainnya. Molekul DNA pada organisme berupa dua rantai doble heliks. Jika suatu rantai DNA memiliki kode GTCCAT maka susunannya adalah 5’ pGpTpCpCpApT – OH 3’. Aturan Chargaff menyatakan bahwa proporsi A selalu sama dengan T dan proporsi G selalu sama dengan C (A=T dan G=C) sehingga proporsi purin sama dengan pirimidin. Rosalind Franklin membuat struktur tiga dimensi berdasarkan studi X-ray Diffraction yang kemudian diperbaiki oleh James Watson dan Francis Crick. Double heliks terjadi karena adanya ikatan dua basa nitrogen yang ada pada dua rantai membentuk pasangan basa. Molekul dupleks DNA terdiri dari rantai paralel dan antiparalel dimana satu rantai 3’ ke 5’ dan rantai lainnya 5’ ke 3’. Pasangan basa membentuk ikatan planar yang menghasilkan interaksi hidrofobik yang menstabilkan molekul. Model DNA Watson and Crick menyatakan bahwa adenin membentuk dua ikatan hidrogen dengan timin dan guanin membentuk tiga ikatan hidrogen dengan sitosin.Permasalahan :1.Coba Jelaskan mengenai ikatan fosfoester yang terjadi pada gula pentosa2.Apa yang terjadi jika Ikatan energi tinggi fosfoanhidrat mengalami hidrolisis , Jelaskan proses atau mekanismenya3.Apa perbedaan dan kesamaan Antara RNA dan DNA , jelaskan secara rinci - 3 Comments
- Readmore . . .
- Add Comment
Contoh Penentuan Streokimia pada Monosakarida
Monosakarida digolongkan berdasarkan jumlah atom karbon yang dikandungnya (triosa, tetrosa,pentosa, heksosa, dan heptosa) dan gugus aktifnya, yang bisa berupa aldehida atau keton. Ini kemudian bergabung, menjadi misalnya aldoheksosa dan ketotriosa. Selanjutnya, tiap atom karbon yang mengikat gugus hidroksil (kecuali pada kedua ujungnya) bersifat optik aktif, sehingga menghasilkan beberapa karbohidrat yang berlainan meskipun struktur dasarnya sama. Sebagai contoh, galaktosa adalah aldoheksosa, namun memiliki sifat yang berbeda dari glukosa karena atom-atomnya disusun berlainan.
Seperti semua molekul biologis, monosakarida memiliki stereokimia spesifik. Sama seperti semua asam amino adalah asam L-amino, semua monosakarida adalah D-gula sehubungan dengan gula basa (gliseraldehida atau dihidroksiaseton).
Dalam kelas biokimia saya, kami diminta untuk dapat mereproduksi proyeksi Fischer dari gula aldehid dan keton utama, dengan stereokimia yang tepat. Sangat penting untuk memperhatikan bahwa karbon-1 dalam gula aldehida SELALU HC = O, dan karbon 1 dalam gula keton SELALU CH2OH. Demikian juga, karbon terminal dalam rantai SELALU CH2OH. Juga, ketika Anda sedang membangun gula dan pergi dari 3 hingga 4 hingga 5 hingga 6 karbon, setiap tambahan akan jatuh setelah karbon 1. Dengan demikian, Anda hanya memindahkan sisa molekul ke bawah dan menempel pada karbon lain; oleh karena itu, dua karbon bawah SELALU terlihat persis sama.
Permasalahan :Aldehyde SugarsHC=OHC-OHH2C-OHglyceraldehyde/ \HC=O HC=OHC-OH HO-CHHC-OH HC-OHH2C-OH H2C-OHerythrose threose/ \ / \HC=O HC=O HC=O HC=OHC-OH HO-CH HC-OH HO-CHHC-OH HC-OH HO-CH HO-CHHC-OH HC-OH HC-OH HC-OHH2C-OH H2C-OH H2C-OH H2C-OHribose arabinose xylose lyxose/ \ / \ / \ / \HC=O HC=O HC=O HC=O HC=O HC=O HC=O HC=OHC-OH HO-CH HC-OH HO-CH HC-OH HO-CH HC-OH HO-CHHC-OH HC-OH HO-CH HO-CH HC-OH HC-OH HO-CH HO-CHHC-OH HC-OH HC-OH HC-OH HO-CH HO-CH HO-CH HO-CHHC-OH HC-OH HC-OH HC-OH HC-OH HC-OH HC-OH HC-OHH2C-OH H2C-OH H2C-OH H2C-OH H2C-OH H2C-OH H2C-OH H2C-OHallose | glucose | gulose | galactose |altrose mannose idose taloseKetone Sugarsdihydroxyacetone|H2C-OHC=OHC-OHH2C-OHerythrulose/ \H2C-OH H2C-OHC=O C=OHC-OH HO-CHHC-OH HC-OHH2C-OH H2C-OHribulose xylulose/ \ / \H2C-OH H2C-OH H2C-OH H2C-OHC=O C=O C=O C=OHC-OH HO-CH HC-OH HO-CHHC-OH HC-OH HO-CH HO-CHHC-OH HC-OH HC-OH HC-OHH2C-OH H2C-OH H2C-OH H2C-OHpsicose fructose sorbose tagatoseSebagai contoh penentuan streokimia pada monosakarida :Sedikit ulasan mengenai gula reduksi dan non reduksi
Contoh streokimia
1. Coba Jelaskan dengan analogi mekanisme perubahan Proyeksi fisher menjadi Hawort secara sederhana
2. Mengapa proyeksi hawort tidak menggambarkan struktur monosakarida yang sesungguhnya ?
3. Apa perbedaan dari alpha dan beta , berikan penjelasan dari segi sifat dan interaksinya terhadap monosakarida lain- 4 Comments
- Readmore . . .
- Add Comment
Reaksi-reaksi Spesifik Pada Protein
Kata protein berasal dari kata protos atau proteous yang berarti pertama atau utama. Protein merupakan komponen utama sel hewan atau manusia. Oleh karena sel itu berperan dalam pembentukkan dan pertumbuhan tubuh. Dalam kehidupan protein memegang peranan yang penting pula. Proses kimia dalam tubuh dapat berlangsung dengan baik karena adanya enzim, suatu protein yang berfungsi sebagai biokatalis. Disamping itu hemoglobin dalam butir-butir darah merah atau eritrosit yang berfungsi sebagai pengangkut oksigen dari paru-paru ke seluruh bagian tubuh adalah salah satu jenis protein. Demikian pula zat-zat yang berperan untuk melawan bakteri penyakit atau yang disebut antigen, juga suatu protein .Dari struktur umumnya, asam amino mempunyai dua gugus pada tiap molekulnya, yaitu gugus amino dan gugus karboksil, yang digambarkan sebagai struktur ion dipolar. Gugus amino dan gugus karboksil pada asam amino menunjukkan sifat-sifat spesifiknya. Karena asam amino mengandung kedua gugus tersebut, senyawa ini akan memberikan reaksi kimia yang yang mencirikan gugus-gugusnya. Sebagai contoh adalah reaksi asetilasi dan esterifikasi. Asam amino juga bersifat amfoter, yaitu dapat bersifat sebagai asam dan memberikan proton kepada basa kuat, atau dapat bersifat sebagai basa dan menerima proton dari basa kuat .Protein merupakan polimer yang tersusun dari asam amino sebagai monomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang mengikat gugus karboksil milik satu monomer dengan gugus amina milik monomer di sebelahnya. Reaksi penyambungan ini (disebut translasi) secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA .Protein sebagai salah satu komponen penyusun bahan pangan mempunyai peranan yang sangat besar dalam menentukan mutu produk pangan. Protein mampu berinteraksi dengan senyawa-senyawa lain, baik secara langsung maupun tidak langsung, sehingga berpengaruh pada aplikasi proses, mutu dan penerimaan produk. Sifat-sifat inilah yang disebut dengan sifat fungsional protein, seperti: water binding, kelarutan, viskositas, pembentukan gel, flavor binding dan aktivitas permukaan. Dengan demikian, protein dari berbagai sumber dapat dikembangkan menjadi produk yang mempunyai sifat-sifat fungsional yang tinggi, menjadi: emulsifier, flavor enhancer, texturizer, stabilizer dan pembentuk gel .Molekul protein tersusun dari sejumlah asam amino sebagai bahan dasar yang saling berkaitan satu sama lain. Ternyata ada 24 jenis rantai cabang R yang berbeda ukuran, bentuk, muatan, dan reaktivitasnya. Rantai cabang R dapat berupa atom H pada glisin, metil pada alanin, atau berupa gugus lainnya, baik gugus alifatik, hidroksil, maupun aromatik.Molekul protein sendiri merupakan rantai panjang yang tersusun oleh matarantai asam-asam amino. Asam amino adalah senyawa yang memiliki satu atau lebih gugus karboksil (-COOH) dan satu atau lebih gugus amino (-NH2) yang salah satunya terletak pada atom C tepat sebelah gugus karboksil (atau atom C alfa). Asam-asam amino yang berbeda-beda (ada 20 jenis asam amino dalam protein alamiah) bersambung melalui ikatan peptida yaitu ikatan antara gugus karboksil suatu asam amino dengan gugus amino dari asam amino yang di sampingnya .Fungsi suatu protein selain sebagai bahan makanan tergantung sepenuhnya pada strukutur tiga dimensionalnya. Pada suatu protein dapat ditambahkan beberapa zat yang dapat merubah struktur sekunder, tersier, dan kuartener dari protein tersaebut. Sebagai contoh: konsentrasi ion yang tinggi dapat mematahkan ikatan S-S diantara cystein. Meskipun zat ini tidak berubah untuk memecahkan ikatan peptida, sehingga struktur primernya tidak berpengaruh, tetapi perlakuan ini dapat merusak sifat protein yang menyebabkan protein tersebut tidak berfungsi semestinya. Protein tersebut mengalami proses denaturasi. Sebagai contoh apabila lisozim di denaturasikan maka protein tersebut tidak dapat lagi merubah polisakarida seperti biasa. Denaturasi suatu enzim menyebabkan enzim itu tidak dapat berfungsi lagi .Denaturasi antibodi menyebabkan zat-zat tersebut tidak dapat mengenal dan bereaksi dengan antigen. Jika fungsi protein tergantung pada konfirmasinya, maka lazim pula dikatakan bahwa konfirmasi protein tergantung pada struktur primernya. Dengan kata lain pada urutan tepat didalam protein tersebut. Jika diambil zat lisozim yang telah di denaturasi dan mengembalikan kondisi pH, kadar garam dan sebagainya dalam kondisi normal, maka lisozim tersebut mendapatkan kembali strukutur sekunder dan tersiernya yang khas. Ini dapat dilihat dari kembalinya sifat katalitik. Begitu juga dengan antibodi, yang dapat didenaturasi secara reversibel, dikembalikan dalam keadaan normal, maka antibodi tersebut memperoleh kembali kemampuannya untuk mengikat antigen .Ada berbagai cara dalam pengujian terhadap protein yaitu dengan reaksi uji asam amino dan reaksi uji protein. Reaksi uji asam amino sendiri terdiri dari 6 macam uji yaitu: uji millon, uji hopkins cole, uji belerang, uji xantroproteat, dan uji biuret. Sedangkan untuk uji protein, berdasarkan pada pengendapan oleh garam, pengendapan oleh logam dan alkohol. Serta uji koagulasi dan denaturasi protein .Reaksi sakaguci dilakukan dengan menggunakan pereaksi nafol dan natrium hipobromit. Pada dasarnya reaksi ini dapat memberi hasil positif apabila ada gugus guanidin. Jadi, arginin atau protein yang mengandung arginin dapat menghasilkan warna merah .Asam amino sendiri tidak berwarna dan tidak dapat dideteksi secara visual pada kromatografi atau cara analisis lainnya. Dengan mengubahnya menjadi senyawa yang berwarna, kita dapat melihatnya. Reaksi warna yang penting dari asam amino adalah reaksinya dengan ninhydrin karena intensitas warna yang terbentuk pada reaksi ninhydrin ini sebanding dengan konsentrasi asam aminonya maka reaksi ini dapat dipakai untuk analisa kuantitatif. Contohnya: reaksi ninhydrin ini dipakai pada alat analisa otomatik asam amino, suatu alat untuk memisahkan asam amino dengan memakai kolom penukar ion dan ditentukan konsentrasi relatifnya .Pada polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil satu asam amino dan gugus -H yang merupakan bagian gugus amina asam amino lainnya akan terlepas dan membentuk air. Oleh sebab itu, reaksi ini termasuk dalam reaksi dehidrasi. Molekul asam amino yang telah melepaskan molekul air dikatakan disebut dalam bentuk residu asam amino .Adapun sifat-sifat dari protein yang membedakannya dari senyawa makromolekul lainnya yakni .1. Bila dibakar berbau rambut terbakar.2. Diendapkan oleh garam-garam logam berat, misalnya air raksa, timah putih dan timah hitam. Hal ini terjadi bila pHnya lebih alkali, dimana logam berat tersebut terikat pada gugus karboksilnya membentuk proteinat logam berat. Reaksi protein dengan logam berat ini dipakai sebagai dasar pertolongan pertama pada keracunan logam berat dengan cara melakukan pemberian protein susu atau telur mentah kepada korban yang belum lama meminum racun tersebut.3. Asam-asam tertentu dapat mengendapkan protein oleh karena protein mengandung gugus –NH2. Asam-asam semacam ini seringkali dinamakan sebagai reagensia alkaloid, misalnya asam trikloroasetat, asam fosfotungstat, asam fosfomolibdat, asam perklorat, asam sulfosalisilat.4. Protein terutama asam amino yang kandungannya menghasilkan beberapa reaksi warna, diantaranya:a. Reaksi Xantoprotein yang berdasarkan reaksi nitrasi benzena asam amino aromatik seperti fenilalanin, tirosin, triptofan.b. Reaksi Millon berdasarkan inti fenol bereaksi dengan reagensia Millon, seperti asam amino tirosin, memberikan warna merah.c. Reaksi Sakaguchi berdasarkan adanya gugus guanidin dengan reagensia Sakaguchi, seperti asam amino arginin, memberikan warna merah.d. Reaksi Biuret berdasarkan adanya dua atau lebih ikatan peptida dengan reagensia Biuret memberikan warna lembayung. Berarti semua protein menghasilkan warna lembayung.
Permasalahan :
1. Salah satu cara untuk menguji madu asli adalah dengan melihat proses koagulasi . Jadi apa penyebab terjadinya koagulasi terhadap kuning telur yang dicampurkan dengan madu tersebut ? kemudian bagaimana interaksi antara protein dengan zat asam pada madu ?
2. Mengapa pada reaksi analisa protein Hopkins-Cole digunakan serbuk magnesium , apa peran dan pengaruh dari zat padat ini ?
3. Jelaskan mengapa hanya beberapa asam amino saja yang dipelajari sebagai komponen utama penyusun protein ? padahal pada kenyatannya ada begitu banyak asam amino yang lainnya- 3 Comments
- Readmore . . .
- Add Comment