- Back to Home »
- Analisis Pembentukan Struktur Sekunder dan Tersier Pada Protein
Saturday, April 14, 2018
Protein adalah makromolekul yang paling banyak ditemukan di dalam sel makhluk hidup dan merupakan 50 persen atau lebih dari berat kering sel. Protein memiliki jumlah yang sangat bervariasi yang mulai dari struktur maupun fungsinya. Peranan protein diantaranya sebagai katalisator, pendukung, cadangan, sistem imun, alat gerak, sistem transpor, dan respon kimiawi. Protein-protein tersebut merupakan hasil ekspresi dari informasi genetik masing-masing suatu organisme tak terkecuali pada bakteri (Campbell et al., 2009; Lehninger et al., 2004). Protein dan gen memiliki hubungan yang sangat dekat dimana kode genetik berupa DNA dienkripsi dalam bentuk kromosom yang selanjutnya kode genetik tersebut ditranslasikan menjadi protein melalui serangkain mekanisme yang melibatkan RNA dan ribosom (Vo-Dinh, 2005).
PENYUSUN PROTEIN
Protein tersusun dari peptida-peptida sehingga membentuk suatu polimer yang disebut polipeptida. Setiap monomernya tersusun atas suatu asam amino. Asam amino adalah molekul organik yang memiliki gugus karboksil dan gugus amino yang mana pada bagian pusat asam amino terdapat suatu atom karbon asimetrik (Gambar 1). Pada keempat pasangannya yang berbeda itu adalah gugus amino, gugus karboksil, atom hidrogen, dan berbagai gugus yang disimbolkan dengan huruf R. Gugus R disebut juga sebagai Rantai samping yang berbeda dengan gugus amino. (Campbell et al., 2009).

Gambar 1. Struktur umum asam amino (Lehninger et al., 2004).

Gambar 2. Level dari struktur protein (Berg et al., 2006).
STRUKTUR PROTEIN
Protein yang tersusun dari rantai asam amino akan memiliki berbagai macam struktur yang khas pada masing-masing protein. Karena protein disusun oleh asam amino yang berbeda secara kimiawinya, maka suatu protein akan terangkai melalui ikatan peptida dan bahkan terkadang dihubungkan oleh ikatan sulfida. Selanjutnya protein bisa mengalami pelipatan-pelipatan membentuk struktur yang bermacam-macam. Adapun struktur protein meliputi struktur primer, struktur sekunder, struktur tersier, dan struktur kuartener (Gambar 2).
Gambar 3. Reaksi pembentukan peptida melalui reaksi dehidrasi (Voet & Judith, 2009).
Gambar 4. Struktur primer dari protein (Campbell et al., 2009).
Struktur primer merupakan struktur yang sederhana dengan urutan-urutan asam amino yang tersusun secara linear yang mirip seperti tatanan huruf dalam sebuah kata dan tidak terjadi percabangan rantai (Gambar 4). Struktur primer terbentuk melalui ikatan antara gugus α–amino dengan gugus α–karboksil (Gambar 3). Ikatan tersebut dinamakan ikatan peptida atau ikatan amida (Berg et al., 2006; Lodish et al., 2003). Struktur ini dapat menentukan urutan suatu asam amino dari suatu polipeptida (Voet & Judith, 2009).
Struktur sekunder merupakan kombinasi antara struktur primer yang linear distabilkan oleh ikatan hidrogen antara gugus =CO dan =NH di sepanjang tulang belakang polipeptida. Salah satu contoh struktur sekunder adalah α-heliks dan β-pleated (Gambar 5 dan 6). Struktur ini memiliki segmen-segmen dalam polipeptida yang terlilit atau terlipat secara berulang. (Campbell et al., 2009; Conn, 2008).

Gambar 5. Struktur sekunder α-heliks dan β-pleated (Murray et al, 2009).
Struktur α-heliks terbentuk antara masing-masing atom oksigen karbonil pada suatu ikatan peptida dengan hidrogen yang melekat ke gugus amida pada suatu ikatan peptida empat residu asam amino di sepanjang rantai polipeptida (Murray et al, 2009).
Pada struktur sekunder β-pleated terbentuk melalui ikatan hidrogen antara daerah linear rantai polipeptida. β-pleated ditemukan dua macam bentuk, yakni antipararel dan pararel (Gambar 7 dan 8). Keduanya berbeda dalam hal pola ikatan hidrogennya. Pada bentuk konformasi antipararel memiliki konformasi ikatan sebesar 7 Å, sementara konformasi pada bentuk pararel lebih pendek yaitu 6,5 Å (Lehninger et al, 2004). Jika ikatan hidrogen ini dapat terbentuk antara dua rantai polipeptida yang terpisah atau antara dua daerah pada sebuah rantai tunggal yang melipat sendiri yang melibatkan empat struktur asam amino, maka dikenal dengan istilah β turn yang ditunjukkan dalam Gambar 9 (Murray et al, 2009).
Gambar 7. Bentuk konformasi antipararel (Berg, 2006).
Gambar 6. Bentuk konformasi pararel (Berg, 2006).
Gambar 7. Bentuk konformasi β turn yang melibatkan empat residu asam amino (Lehninger et al., 2004).
Struktur tersier dari suatu protein adalah lapisan yang tumpang tindih di atas pola struktur sekunder yang terdiri atas pemutarbalikan tak beraturan dari ikatan antara rantai samping (gugus R) berbagai asam amino (Gambar 10). Struktur ini merupakan konformasi tiga dimensi yang mengacu pada hubungan spasial antar struktur sekunder. Struktur ini distabilkan oleh empat macam ikatan, yakni ikatan hidrogen, ikatan ionik, ikatan kovalen, dan ikatan hidrofobik. Dalam struktur ini, ikatan hidrofobik sangat penting bagi protein. Asam amino yang memiliki sifat hidrofobik akan berikatan di bagian dalam protein globuler yang tidak berikatan dengan air, sementara asam amino yang bersifat hodrofilik secara umum akan berada di sisi permukaan luar yang berikatan dengan air di sekelilingnya (Murray et al, 2009; Lehninger et al, 2004).
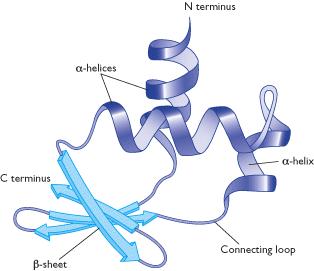
Gambar 8. Bentuk struktur tersier dari protein denitrificans cytochrome C550 pada bakteri Paracoccus denitrificans(Timkovich and Dickerson, 1976).
Struktur kuarterner adalah gambaran dari pengaturan sub-unit atau promoter protein dalam ruang. Struktur ini memiliki dua atau lebih dari sub-unit protein dengan struktur tersier yang akan membentuk protein kompleks yang fungsional. ikatan yang berperan dalam struktur ini adalah ikatan nonkovalen, yakni interaksi elektrostatis, hidrogen, dan hidrofobik. Protein dengan struktur kuarterner sering disebut juga dengan protein multimerik. Jika protein yang tersusun dari dua sub-unit disebut dengan protein dimerik dan jika tersusun dari empat sub-unit disebut dengan protein tetramerik (Gambar 11) (Lodish et al., 2003; Murray et al, 2009).
Gambar 9. Beberapa contoh bentuk struktur kuartener.
Permasalahan :
1.Bagaimana perbedaan antara protein yang tersusun atas ikatan peptida dengan protein yang tersusun oleh ikatan sulfida ?
2.Dengan reaksi apa saja dapat dibentuk ikatan peptida ? jelaskan beserta contohnya
3.Mengapa pada protein struktur sekunder dapat distabilkan oleh ikatan hidrogen antara gugus =CO dan =NH ?
2.Dengan reaksi apa saja dapat dibentuk ikatan peptida ? jelaskan beserta contohnya
3.Mengapa pada protein struktur sekunder dapat distabilkan oleh ikatan hidrogen antara gugus =CO dan =NH ?

















saya akan menjawab no.2
ReplyDeleteIkatan peptida merupakan ikatan yang terbentuk ketika atom karbon pada gugus karboksil suatu molekul berbagi elektron dengan atom nitrogen pada gugus amina molekul lainnya. ikatan peptida hanya terdapat pada protein.
Reaksi yang terjadi merupakan reaksi kondensasi, hal ini ditandai dengan lepasnya molekul air ketika reaksi berlangsung. Hasil dari ikatan ini merupakan ikatan CO-NH, dan menghasilkan molekul yang disebut amida. Ikatan peptida ini dapat menyerap panjang gelombang 190-230 nm
contohnya:
https://id.wikipedia.org/wiki/Berkas:Peptide_bond_formation.svg
Saya demiati akan membahas pertanyaan nomor 3, yang mana
ReplyDeleteHeliks alfa distabilkan oleh ikatan hidrogen antara NH dan kelompok CO dari rantai utama Yaitu kelompok CO dari masing-masing asam amino membentuk ikatan-H dengan gugus NH dari asam amino Ie yang terletak empat residu ke depan dalam urutan.
Hidrogen melekat langsung ke salah satu unsur yang paling elektronegatif, menyebabkan hidrogen memperoleh muatan positif dalam jumlah yang signifikan.Setiap elemen yang dilekatkan hidrogen tidak hanya signifikan negatif, tetapi juga memiliki setidaknya satu pasangan elektron aktif "aktif".
Ikatan hidrogen dalam molekul organik yang mengandung nitrogen
Ikatan hidrogen juga terjadi pada molekul organik yang mengandung gugus N-H - dengan cara yang sama seperti yang terjadi pada amonia. Contohnya berkisar dari molekul sederhana seperti CH3NH2 (methylamine) hingga molekul besar seperti protein dan DNA.
Dua helai heliks ganda yang terkenal dalam DNA dipegang bersama oleh ikatan hidrogen antara atom hidrogen yang terikat pada nitrogen pada satu untai, dan pasangan elektron bebas pada nitrogen lain atau oksigen di satu lainnya.
Make yang dapat Saya simpulkan Dari uraian diatas, bahwasanya ikatan hidrogen disini dappy menstabilkan struktur Dari proteins sekunder karena memiliki guys N-H
disini saya akan menjawab permasalahan no.1
ReplyDeleteIkatan peptida merupakan ikatan yang terbentuk ketika atom karbon pada gugus karboksil suatu molekul berbagi elektron dengan atom nitrogen pada gugus amina molekul lainnya. ikatan peptida hanya terdapat pada protein. biasanya protein primer,sekunder,
Reaksi yang terjadi merupakan reaksi kondensasi, hal ini ditandai dengan lepasnya molekul air ketika reaksi berlangsung. Hasil dari ikatan ini merupakan ikatan CO-NH, dan menghasilkan molekul yang disebut amida.
Sedangkan ikatan sulfida biasanya untuk protein tersier ( yaitu ikatan antara karbon karboksil nya paling kuat jika dengan disulfida.